Tekanan
Tekanan dijelaskan oleh teori kinetik sebagai kemunculan dari gaya yang dihasilkan oleh molekul-molekul gas yang menabrak dinding wadah. Misalkan suatu gas denagn N molekul, masing-masing bermassa m, terisolasi di dalam wadah yang mirip kubus bervolume V. Ketika sebuah molekul gas menumbuk dinding wadah yang tegak lurus terhadap sumbu koordinat x dan memantul dengan arah berlawanan pada laju yang sama (suatu tumbukan lenting), maka momentum yang dilepaskan oleh partikel dan diraih oleh dinding adalah:
di mana vx adalah komponen-x dari kecepatan awal partikel.
Partikel memberi tumbukan kepada dinding sekali setiap 2l/vx satuan waktu (di mana l adalah panjang wadah). Kendati partikel menumbuk sebuah dinding sekali setiap 1l/vx satuan waktu, hanya perubahan momentum pada dinding yang dianggap, sehingga partikel menghasilkan perubahan momentum pada dinding tertentu sekali setiap 2l/vx satuan waktu.
gaya yang dimunculkan partikel ini adalah:
Keseluruhan gaya yang menumbuk dinding adalah:
di mana hasil jumlahnya adalah semua molekul gas di dalam wadah.
Besaran kecepatan untuk tiap-tiap partikel mengikuti persamaan ini:
Kini perhatikan gaya keseluruhan yang menumbuk keenam-enam dinding, dengan menambahkan sumbangan dari tiap-tiap arah, kita punya:
di mana faktor dua muncul sejak saat ini, dengan memperhatikan kedua-dua dinding menurut arah yang diberikan.
Misalkan ada sejumlah besar partikel yang bergerak cukup acak, gaay pada tiap-tiap dinding akan hampir sama dan kini perhatikanlah gaya pada satu dinding saja, kita punya:
Kuantitas  dapat dituliskan sebagai
dapat dituliskan sebagai 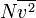 , di mana garis atas menunjukkan rata-rata, pada kasus ini rata-rata semua partikel. Kuantitas ini juga dinyatakan dengan
, di mana garis atas menunjukkan rata-rata, pada kasus ini rata-rata semua partikel. Kuantitas ini juga dinyatakan dengan  di mana vrms dalah akar kuadrat rata-rata kecepatan semua partikel.
di mana vrms dalah akar kuadrat rata-rata kecepatan semua partikel.
Jadi, gaya dapat dituliskan sebagai:
Tekanan, yakni gaya per satuan luas, dari gas dapat dituliskan sebagai:
di mana A adalah luas dinding sasaran gaya.
Jadi, karena luas bagian yang berseberangan dikali dengan panjang sama dengan volume, kita punya pernyataan berikut untuk tekanan
di mana V adalah volume. Maka kita punya
Karena Nm adalah masa keseluruhan gas, maka kepadatan adalah massa dibagi oleh volume 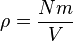 .
.
Maka tekanan adalah
Hasil ini menarik dan penting, sebab ia menghubungkan tekanan, sifat makroskopik, terhadap energi kinetik translasional rata-rata per molekul  yakni suatu sifat mikroskopik. Ketahuilah bahwa hasil kali tekanan dan volume adalah sepertiga dari keseluruhan energi kinetik.
yakni suatu sifat mikroskopik. Ketahuilah bahwa hasil kali tekanan dan volume adalah sepertiga dari keseluruhan energi kinetik.
Suhu dan energi kinetik
Dari hukum gas ideal
-
- PV = NkBT(1)
dimana B adalah konstanta Boltzmann dan T adalah suhu absolut. Dan dari rumus diatas, dihasilkan Gagal memparse (kesalahan sintaks): PV={Nmv_{rms}^2\overset 3}
Derivat:
-

 (2)
(2)
yang menuju ke fungsi energi kinetik dari sebuah molekul
Energi kinetik dari sistem adalah N kali lipat dari molekul 
Suhunya menjadi
-
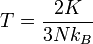 (3)
(3)
Persamaan 3 ini adalah salah satu hasil penting dari teori kinetik
| “ | Rerata energi kinetik molekuler adalah sebanding dengan suhu absolut. | ” |
Dari persamaan 1 dan 3 didapat:
-
 (4)
(4)
Dengan demikian, hasil dari tekanan dan volume tiap mol sebanding dengan rerata energi kinetik molekuler. Persamaan 1 dan 4 disebut dengan hasil klasik, yang juga dapat diturunkan dari mekanika statistik[1].
Karena 3N adalah derajat kebebasan (DK) dalam sebuah sistem gas monoatomik dengan N partikel, energi kinetik tiap DK adalah:
-
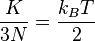 (5)
(5)
Dalam energi kinetik tiap DK, konstanta kesetaraan suhu adalah setengah dari konstanta Boltzmann. Hasil ini berhubungan dengan teorema ekuipartisi. Seperti yang dijelaskan pada artikel kapasitas bahang, gas diatomik seharusnya mempunyai 7 derajat kebebasan, tetapi gas yang lebih ringan berlaku sebagai gas yang hanya mempunyai 5. Dengan demikian, energi kinetik tiap kelvin (gas ideal monoatomik) adalah:
- Tiap mole: 12.47 J
- Tiap molekul: 20.7 yJ = 129 μeV
Pada STP (273,15 K , 1 atm), didapat:
- Tiap mole: 3406 J
- Tiap molekul: 5.65 zJ = 35.2 meV
Banyaknya tumbukan dengan dinding
Jumlah tumbukan atom dengan dinding wadah tiap satuan luar tiap satuan waktu dapat diketahui. Asumsikan pada gas ideal, derivasi dari [2] menghasilkan persamaan untuk jumlah seluruh tumbukan tiap satuan waktu tiap satuan luas:
Laju RMS molekul
Dari persamaan energi kinetik dapat ditunjukkan bahwa:
dengan v pada m/s, T pada kelvin, dan R adalah konstanta gas. Massa molar diberikan sebagai kg/mol. Kelajuan paling mungkin adalah 81.6% dari kelajuan RMS, dan rerata kelajuannya 92.1% (distribusi kelajuan Maxwell-Boltzmann).







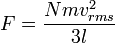

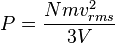


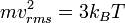


Tidak ada komentar:
Posting Komentar